بررسی فراوانی ژنهای حدت اگزوتوکسین A، اگزوآنزیم، آلژینات و oprI وoprL در جدایههای سودوموناس آئروژینوزا دامی و انسانی و تعیین الگوی مقاومت آنتیبیوتیکی
چکیده
زمینه و اهداف: سودوموناس آئروژینوزا مهمترین عامل عفونتهای مختلف بیمارستانی و ورم پستان در گاوهای شیری و ایجاد مقاومت آنتیبیوتیکی محسوب میشود. هدف این مطالعه تعیین مقاومت آنتیبیوتیکی باکتری سودوموناس آئروژینوزا و حضور ژنهایحدت در نمونههای انسانی و دامی بوده است.
مواد و روش کار: در این تحقیق 102 سویه انسانی و دامی از سودوموناس آئروژینوزا مورد بررسی قرار گرفت. در بررسی عوامل حدت باروش Multiplex PCR جهت تشخیص ژنهای اختصاصی استفاده شد. همچنین آزمایش دیسک دیفیوژن و E-test بر اساس روشCLSI با آنتیبیوتیکهای مختلف انجام گردید.
یافتهها: نتایج آنتیبیوگرام جدایههای انسانی سودوموناس آئزوژینوزا نشان داد که بیشترین میزان مقاومت نسبت به آنتیبیوتیکهای آمپیسیلین و سفپیم (100 %)، و بیشترین میزان مقاومت در جدایههای دامی نسبت به آمپیسیلین (100%) وجود دارد. شیوع ژنoprI در 100 درصد جدایههای انسانی شناسایی و تمام نمونهها از نظر وجود ژن alg-D منفی بودند. برخلاف نمونههای انسانی، تمامی نمونههای دامی از نظر وجود اگزوآنزیم S منفی بوده و فقط اگزوآنزیم Y در 15جدایه (25%) شناسایی شد. در جدایههای انسانی اگزوآنزیم T از بیشترین فراوانی برخوردار بود. به گونه ای که 100 % نمونهها از نظر این اگزوآنزیم مثبت بودند.
بحث: شیوع بالایی ژنهای حدت در بین ایزولههای انسانی و دامی و توجه به عملکرد این ژنها، در جهت شناسایی تاثیر بر بافتهای دامی و انسانی را ضروری میسازد. با توجه به بالا بودن میزان مقاومت آنتیبیوتیکی در سویههای دامی و انسانی، مصرف مناسب و به اندازه آنتی بیوتیکها میبایست رعایت گردد.
مقدمه
جنس سودوموناس از گروههای بزرگ باکتریها بوده که بیش از 80 گونه از آن تاکنون شناخته شده است. این باکتری شیمو ارگانوترروف بوده ولی برخی از انواع نیز شیمولیتوتروف اختیاری بوده و قادرند هیدروژن و دی اکسید کربن را به عنوان منابع انرژی به کار برند. در سال 1850، سدیلوت (Sedillot) ترشحات چرک سبز-آبی را در زخمهای جراحی گزارش کردند که این زخمها بسیار دیر بهبود مییافت. محققین 10 پمپ پروتئینی را روی غشای خارجی سودوموناس آئروژینوزا شناسایی کردهاند که مقاومت باکتری را در برابر دترجنتها و آنتی بیوتیکها به آنها نسبت میدهند2،1. این باکتري داراي قدرت آنزیمی فوق العادهاي بوده که امکان بقاي آن را در شرایط مختلف فراهم میسازد. بیماريزایی سودوموناس آئروژینوزا به علت تولید چندین فاکتور حدت همراه سلول و فاکتورهاي خارج سلولی است. لیپوپلی ساکارید خاصیت اندوتوکسینی دارد و پیوسـیـانـیـن تولید اشکال سمی اکسیژن مانند سوپراکسید و هیدروژن پراکسید را کاتالیز میکند3. سودوموناس آئروژینوزا مانند باکتریهای گرم منفی دیگر، دارای سیستم ترشحی تیپ III می باشد. فاکتورهای این سیستم ترشحی شامل چهار اگزوآنزیم میباشد که ExoS ،ExoT ، ExoUو ExoY است. ژنهای مربوط به آنها تقریبا در اکثر ایزولههای بالینی و محیطی وجود داشته و در میان این چهار آنزیم، ExoS از بقیه مهم تر و اگزوآنزیم S مانند اگزوتوکسین A دارای فعالیت ADP – ریبوزیل ترانسفرازی است ولی سوبسترای آن به جای 2-EF یک پروتئین فیلامنتوس به نام ویمنتین میباشد. مشخص شده است سویههای فاقد ژن ExoS در مدل حیوانی کمتر ویرولانس بوده ExoT هم دارای فعالیت ADP – ریبوزیل ترانسفرازی بوده وExoU نوعی فسفولیپاز ولی ExoY نقش آدنیلات سیکلازی دارد4. سودوموناس آئروژینوزا به شدت با بیماران سرطانی و سوختگی در انسان و افرادیکه سیستم ایمنی آنها سرکوب شده است ارتباط دارد. میزان مرگ برای افراد مبتلا به این باکتری حدود ۵۰ درصد است .عفونت گوش میانی (Swimmers ear)، پوستی (به خصوص افراد دچار سوختگی)، باکتریمی، عفونت مغز استخوان و مفاصل، مننژیت و آبسههای مغزی، کراتیت، انتروکولیت، تب شانگهای (مشابه حصبه)، اندوکاردیت، پنومونی و عفونت مجاری ادراری میگردد. فقط در آبسهها سودوموناس نبوده چون هوازی اجباری است5. مقاومت ذاتی باکتری سودوموناس آئروژینوزا به آنتیبیوتیکها به دلیل حضور پروتئینهای اختصاصی موجود در غشای خارجی این باکتری میباشد. دو لیپوپروتئین موجود در غشای خارجی شامل ژنهای oprI و oprL است که با تاثیر بر روی سیستم انتشار دارو و ناتراوایی در غشای سلول باکتری موجب ایجاد مقاومت در سودوموناس آئروژینوزا میگردد. شناسایی این دو ژن در این باکتری هم موجب تفکیک باکتری سودوموناس آئروژینوزا از سایر گونههای سودوموناس شده و هم از جهت بررسی مقاومت در باکتری سودوموناس آئروژینوزا دارای اهمیت میباشد6. در دامها این باکتری از عوامل بیماریزای مقاوم به درمان بوده که ضررهای اقتصادی بالایی را به صنعت دامپروری وارد میکند. سودوموناس آئروژینوزا، به عنوان یکی از عوامل ایجاد کننده ورم پستانهای کلینیکی با شیوع ناگهانی در گاوهای شیری مطرح است. این باکتری کمتر از 1% و یا بیشتر از 3% گله را درگیر کرده و موجب ورم پستانهای مزمن تحت بالینی میشود7. سودوموناس آئروژینوزا در آمریکا بیش از 2 بیلیون دلار، انگلستان 93 میلیون یورو و در استرالیا 100 میلیون دلار سالانه ضرر اقتصادی را به دامداران تحمیل میکند8. بیماری ورم پستان کلینیکی ناشی از سودوموناس آئروژینوزا در اثر عواملی مانند آب آلوده، ضدعفونی نامناسب کارتیهها و درمان نامناسب در دوران خشکی ایجاد میگردد و کارتیههای گاو به عنوان مخزن انتقال باکتری سودوموناس آئروژینوزا عمل مینماید. ورم پستان حاد ناشی از سودوموناس آئروژینوزا معمولاً به عفونت مزمن تبدیل شده و حتی گانگرونوز حاد در 10% موارد ابتلاء به ورم پستان گزارش شده است. آنزیمهای تولید شده توسط سودوموناس آئروژینوزا در شیر در دمای پاستوریزاسیون باقی مانده و موجب تخریب چربی شیر و محصولات لبنی میگردد (7). دیووس و همکاران با روش Multiplex PCR ژنهای oprI و oprL سودوموناس آئروژینوزا را در نمونههای کلینیکی شناسایی نموده و به نقش این دو ژن در ایجاد مقاومت در این باکتری اشاره نمودهاند. در کلیه نمونههای بالینی و محیطی مورد بررسی، این دو ژن شناسایی شده و میزان حساسیت این روش را 100% و ویژگی 74% در مقایسه با روش کشت اعلام نمودند9. اگزوتوکسینA سودوموناس آئروژینوزا، یکی از معدود توکسینهای باکتریایی است که مکانیسم عملش در سطح مولکولی مشخص شده است. چون اگزوتوکسینA ، دارای خواص متوقف سازی سنتز پروتئین میباشد، میتواند در ساخت ایمونوتوکسینها استفاده گردد. این ترکیب برای ماکروفاژهای انسانی سیتوتوکسیک بوده و از پاسخ دهی سلولهای طحال موش هم ممانعت به عمل میآورد. از فعالیت سلولهای تک هسته ای انسانی جلوگیری کرده و جلوی فعالیت پروجنیتورهای گرانولوسیت-ماکروفاژ را در مغز استخوان انسان میگیرد10. سنا حسین در سال 2013، ژنهای Exot A و oprI را در نمونههای سودوموناس آئروژینوزا جداشده از نمونههای بالینی مورد بررسی قرار داد، که در نتایج این تحقیق تمام نمونهها دارای ژن oprI بوده ولی 80% نمونهها واجد ژن Exot A بودند و استفاده از روشهای ملکولی را بر ای تعیین تولید توکسین موثر اعلام نمود11. Feltman و همکارانexoS را در 67 (71%) از 95 سویه بالینی مورد بررسی شناسایی نمودند. این نتایج در مقایسه با گزارشات قبلی که حضور
ژن exoS را در تمام سویههای بالینی سودوموناس آئروژینوزا منفی اعلان کرده بودند، تفاوت دارد. با این حال، برآورد شیوع واقعی این ژن یا تولید ExoS به طور قابل توجهی متفاوت است12. آلژینات امکان بقاء و حالت تهاجمی سودوموناس آئروژینوزا را با استفاده از چندین استراتژی افزایش میدهد، به عنوان یک سد حفاظتی برای سلولهای باکتری در مقابل فاگوسیتها و آنتی بیوتیکها عمل میکند، دلیل این ویژگی خصوصیت اسیدی این پلیمر و توانایی به دام انداختن آنتی بیوتیکهای کاتیونی است و همچنین میتواند رادیکالهای اکسیداتیو که توسط سلولهای فاگوسیت رها میشوند را فروبنشاند. آلژینات دارای 12 ژن از جمله algA و algD میباشد و این ژنها تحت کنترل پروموتر آلژینات D قرار دارند. ژنهای algA, algC و algD آنزیمهای لازم برای بیوسنتز پیشرو آلژینات –GDP مانورونیک اسید را رمزدهی میکنند. ژنهای alg44 ;algK ;algX و ;alg8در پلیمریزاسیون، ژنهایalgL algG ;algF ;algJ و ;algIدر تغییرات و ژن algE در خروج آلژینات از غشای خارجی دخالت دارند.
مواد و روشها
جمعآوری و انتقال نمونه
در این مطالعه توصیفی-مقطعی که در بازه زمانی بین تابستان 1393 تا آذر ماه 1396 به طول انجامید، تعداد 51 مورد نمونههای انسانی (خلط، خون، ادرار، ترشحات زخم) از مراکز درمانی بیمارستانی تهران که مشکوک به سودوموناس بوده و 51 نمونههای دامی از شیر خام دامداریهای مختلف استان تهران که دارای علائم ورم پستان بودند، جمعآوری و با انتقال به آزمایشگاه، کشت ابتدایی بر روی نمونهها انجام شد. برای کشت از محیطهای بلادآگار و مککانکی آگار و ستریمیدآگار (مرک، آلمان) استفاده و بعد از انکوباسیون به مدت 24 ساعت در 37 درجه سانتیگراد، کلونیهای رشد یافته از نظر مورفولوژی و تولید
رنگدانه بررسی و پس از رنگآمیزی گرم، باکتریهای لاکتوز منفی برای انجام آزمونهای تاییدی خالص سازی شدند. آزمونهای اکسیداز و کشت بر روی محیط TSI (مرک، آلمان)، تست اورهآز، سیمون سیترات جهت تایید باکتری سودوموناس آئروژینوزا انجام شد13.
آنتیبیوگرام
بعد از تایید نهایی باکتری سودوموناس آئروژینوزا جداسازی شده، نمونهها بر روی محیط مولرهینتون آگار (مرک، آلمان) کشت داده شد. دیسکهای آنتیبیوتیکی تجاری از شرکتHimedia Laboratories Pvt.Limited-India) ) تهیه گردید. این دیسکها شامل سیپروفلوکساسین (µg 5)، آمیکاسین (µg 30)، سفتریاکسون (µg 30)، سفتازیدیم (µg 30)، آمپی سیلین (µg 10)، سفپیم (µg 30)، ایمی پنم(µg 10)، جنتامایسین (µg 10)، کانامایسین (µg 30)، مروپنم (µg 10) و تتراسایکلین (µg 30) و انروفلوکساسین (µg 10) بود که بعد از قرار دادن بر روی محیط مولر هینتون، به مدت 24 ساعت در گرمخانه قرار گرفت. بعد از گرمخانهگذاری، نتایج قرائت و قطرهاله عدم رشد و مقاومت باکتری به آنتیبیوتیک براساس جدول (CLSI)Clinical and Laboratory Standards Institute ثبت گردید14.
تعیین میزان کمترین غلظت ممانعت از رشد MIC به روش E.test
جهت انجام آزمایش تعیین حداقل غلظت ممانعت از رشد MIC ( Minimum Inhibitory Concentration) از روش E.test (Epsilometer test) استفاده گردید. این آزمایش بر روی نمونههای انسانی با آنتیبیوتیکهای آمیکاسین، جنتامایسین، سیپروفلوکساسین، مروپنم، ایمیپنم و سفپیم تهیه شده از شرکت HIMEDIA Pvt.Limited-INDIA) Himedia Laboratories) انجام شد. برای انجام این تست بر روی نمونههای دامی با آنتیبیوتیکهای آمیکاسین، جنتامایسین و سیپروفلوکساسین انجام گردید. در این مطالعه از نوارهای E.test از نوع
Strip (نواری) و Comb (شانهای) استفاده شد. در روش E.test پس از تهیه سوسپانسیون باکتریایی به روش نیم مک فارلند برای نمونههای مورد مطالعه، با سوآپ استریل بر روی پلیت مولر هینتون آگار کشت داده و سپس نوارهای را که هرکدام معرف یک نوع آنتی بیوتیک بوده بر روی آگار قرار داده و پس از 24 ساعت انکوباسیون در 37 درجه منطقه عدم رشد که به شکل گلابی شکل ایجاد شده بود را در حدفاصل کمترین نقطه تماس با نوار آنتیبیوتیکی قرائت شد15.
استخراج DNA باکتری
برای استخراج DNA باکتری از کیت تجاری MBST (Molecular Biology Transfer System) جهت استخراج DNA استفاده نموده و پس از استخراج DNA در فریزر 20- درجهسانتیگراد تا انجام آزمونهای ملکولی ذخیره گردید. همچنین پرایمرهای مورد نیاز این طرح شامل پرایمر Exot A، اگزوآنزیمS و آلژینات و پرایمر ژنهای oprI و oprL (طبق جداول 1 و 2) به شرکت (تکاپوزیست) سفارش داده شد16. بعد از انجام روند آزمون و انتقال محصول به روی ژل و مشاهده در دستگاه دادهها آنالیز گردید.
برنامه زمانی و میزان مخلوط واکنش Multiplex-PCR ژنهای حدت
برنامه آزمون Multiplex-PCR: مرحله دناتوراسیون اولیه 95 درجه سانتیگراد به مدت 10 دقیقه، مرحله دناتوراسیون 94 درجه سانتیگراد به مدت 30 ثانیه، مرحله اتصال 55 درجه سانتیگراد به مدت 70 ثانیه، مرحله بسط 72 درجه سانتیگراد به مدت 1 دقیقه (تعداد 35 سیکل)، مرحله بسط نهایی 72 درجه سانتیگراد به مدت 10 دقیقه میباشد. مخلوطهای استفاده شده جهت انجام واکنش به این شرح میباشد: آب مقطر 5/3 میکرولیتر، Master Mix شرکت Amplicon به میزان 5/12 میکرولیتر، پرایمرهای مورد استفاده هرکدام 5/0 میکرولیتر، نمونه DNA 4 میکرولیتر در حجم نهایی 25 میکرولیتر تهیه گردید17.
جدول 1: پرایمرهای مورد استفاده در این تحقیق برای شناسایی ژنهای حدت 17
| جدول پرايمرهاي مورد استفاده | |||
| اندازه باند (bp) | ژن هدف | توالی پرایمر (5’ to 3’) | پرایمر |
| 396 | ETA | GACAACGCCCTCAGCATCACCAGC | ETA-F |
| 396 | ETA | CGCTGGCCCATTCGCTCCAGCGCT | ETA-R |
| 504 | oprL | ATG GAAATGCTGAAATTCGGC | oprL-F |
| 504 | oprL | CTTCTTCAGCTCGACGCGACG | oprL-R |
| 249 | oprI | ATGAACAACGTTCTGAAATTCTCTGCT | oprI-F |
| 249 | oprI | CTTGCGGCTGGCTTTTTCCAG | oprI-R |
| 520 | Alg
Alg |
TTCCCTCGCAGAGAAAACATC
CCTGGTTGATCAGGTCGATCT |
Alg-F
Alg-R |
جدول 2: مشخصات پرایمرها جهت تکثیر ژنهای اگزوتوکسین جدایههای سودوموناس آئروژینوزا 18
| طول قطعه bp | توالی DNA پرایمر | ژن تکثیر یافته | ||
| 118 |
|
exo S | ||
| 152 |
|
exo T | ||
| 134 | F, (5΄-CCG TTG TGG TGC CGT TGA AG-3΄)
R, (5΄-CCA GAT GTT CAC CGA CTC GC-3΄ |
exo U | ||
| 289 | F, (5΄-CGG ATT CTA TGG CAG GGA GG-3΄)
R, (5΄-GCC CTT GAT GCA CTC GAC CA-3΄ |
exo Y |
برنامه زمانی و میزان مخلوط واکنش PCR جهت شناسایی تکثیر ژنهای اگزوتوکسین جدایههای سودوموناس آئروژینوزا
برنامه آزمون Multiplex-PCR شامل مرحله دناتوراسیون اولیه 94 درجه سانتیگراد به مدت 3 دقیقه، مرحله دناتوراسیون 94 درجه سانتیگراد به مدت 40 ثانیه، مرحله اتصال 58 درجه سانتیگراد به مدت 40ثانیه، مرحله بسط 68 درجه سانتیگراد به مدت 1 دقیقه (تعداد 36 سیکل)، مرحله بسط نهایی 68 درجه سانتیگراد به مدت 7 دقیقه میباشد. مخلوطهای استفاده شده جهت انجام واکنش به این شرح میباشد: آب مقطر 5/6 میکرولیتر، Master Mix شرکت Amplicon به میزان 5/12 میکرولیتر، پرایمرهای مورد استفاده هرکدام 5/0 میکرولیتر، نمونه DNA 2 میکرولیتر در حجم نهایی 25 میکرولیتر تهیه گردید18.
نتایج
بعد از جمع آوری تعداد 102 نمونههای انسانی و نمونههای دامی و انتقال به آزمایشگاه، کشت بر روی محیطهای اختصاصی انجام شد و بعد از انکوباسیون به مدت 24 ساعت در 37 درجه سانتیگراد، کلونیهای رشد یافته از نظر مورفولوژی و تولید رنگدانه بررسی و پس از رنگ آمیزی گرم، باکتریهای گرم منفی و لاکتوز منفی برای انجام آزمونهای تاییدی خالص سازی شدند. در نهایت تمامی جدایههایی که وارد مطالعه شدند از نظر الگوی تستهای افتراقی به صورت زیر مشاهده شدند. در نهایت 51 نمونه انسانی و 51 نمونه دامی شناسایی گردید. کشت برروی محیط ستریمید آگار و براث پیگمان سبز مایل به آبی رانشان داد، هرچند برخی نمونهها پیگمان قرمز هم از خود بروز دادند. تست سیترات تمامی جدایهها مثبت و تست اندول تمامی جدایهها منفی و تستVP تمامی جدایهها منفی و تست متیل رد وتست اکسیداز تمامی جدایهها مثبت و تست کاتالاز تمامی
جدایهها مثبت و تمامی جدایهها در محیط کشت ستریمید رشد و تولید پیگمان کردند. جدایهها بعد از رشد در محیط TSI به صورت ALK/ALK مشاهده شدند. آزمون اوره تمامی جدایهها شناسایی شده مثبت گزارش گردید.
نتایج Multiplex-PCR جدایههای انسانی از نظر اگزوآنزیمهای S,U,Y,T
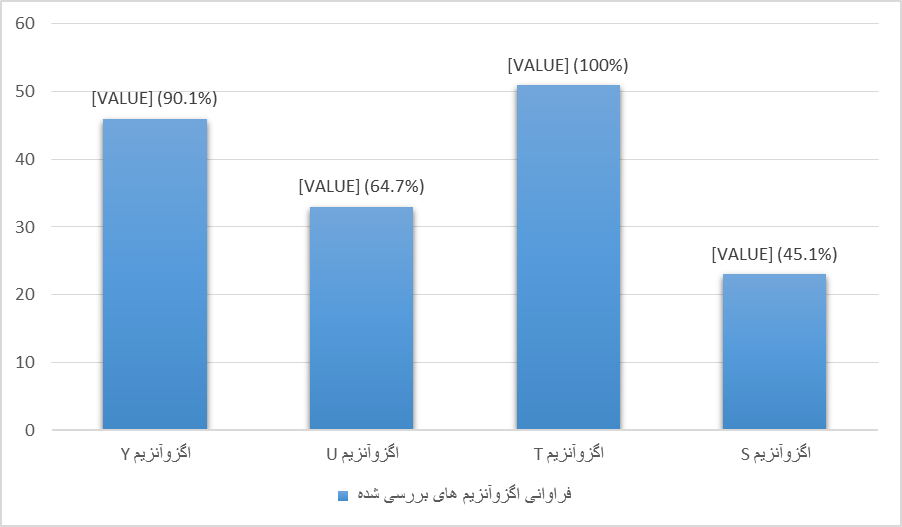
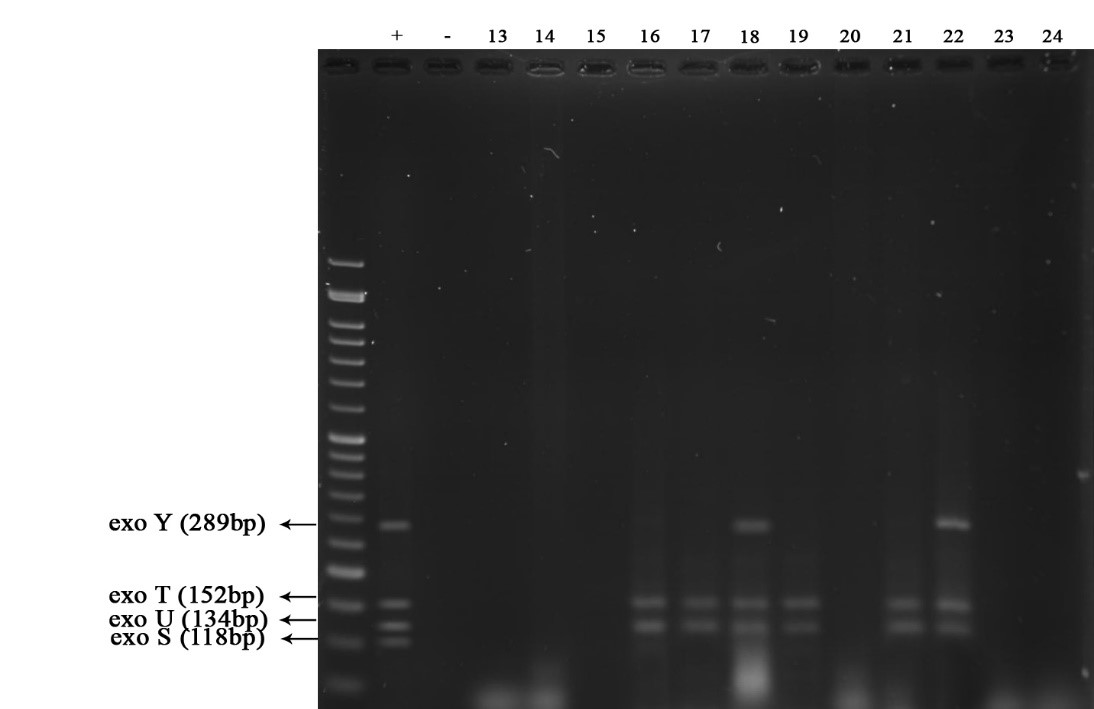
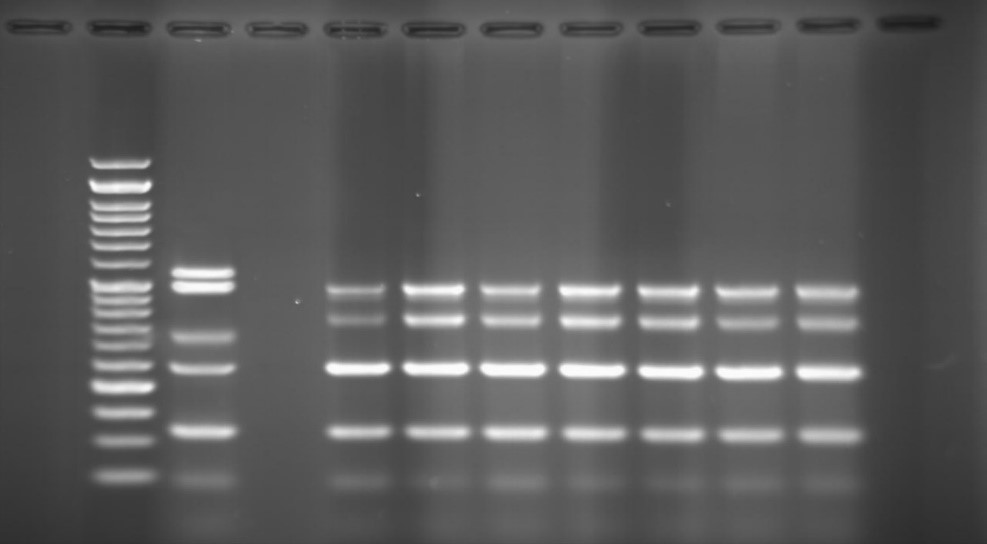
در جدایههای انسانی سودوموناس آئروژینوزای بررسی شده در این مطالعه از نظر وجود ژنهای اگزوآنزیمهای Y با طول باند bp 289، U با طول باند bp 134، T با طول باند bp 152 و S با طول باند bp 118، اگزوآنزیم T از بیشترین فراوانی
برخوردار بود. به گونه ای که 100 % نمونهها از نظر این اگزوآنزیم مثبت بودند (شکل 1). فراوانی و درصد هر یک از اگزوآنزیمهای بررسی شده در نمودار 1 آمده است.
نتایج Multiplex-PCR جدایههای دامی از نظر اگزوآنزیمهای S,U,Y,T
برخلاف نمونههای انسانی، فراوانی این اگزوآنزیمها در نمونههای دامی خیلی کمتر بوده است (شکل 2). تمامی نمونهها از نظر وجود اگزوآنزیم S منفی بودند و فقط اگزوآنزیم Y در 15 جدایه (25%) و اگزوآنزیم U و T در (6/68%) شناسایی شد (نمودار 2).
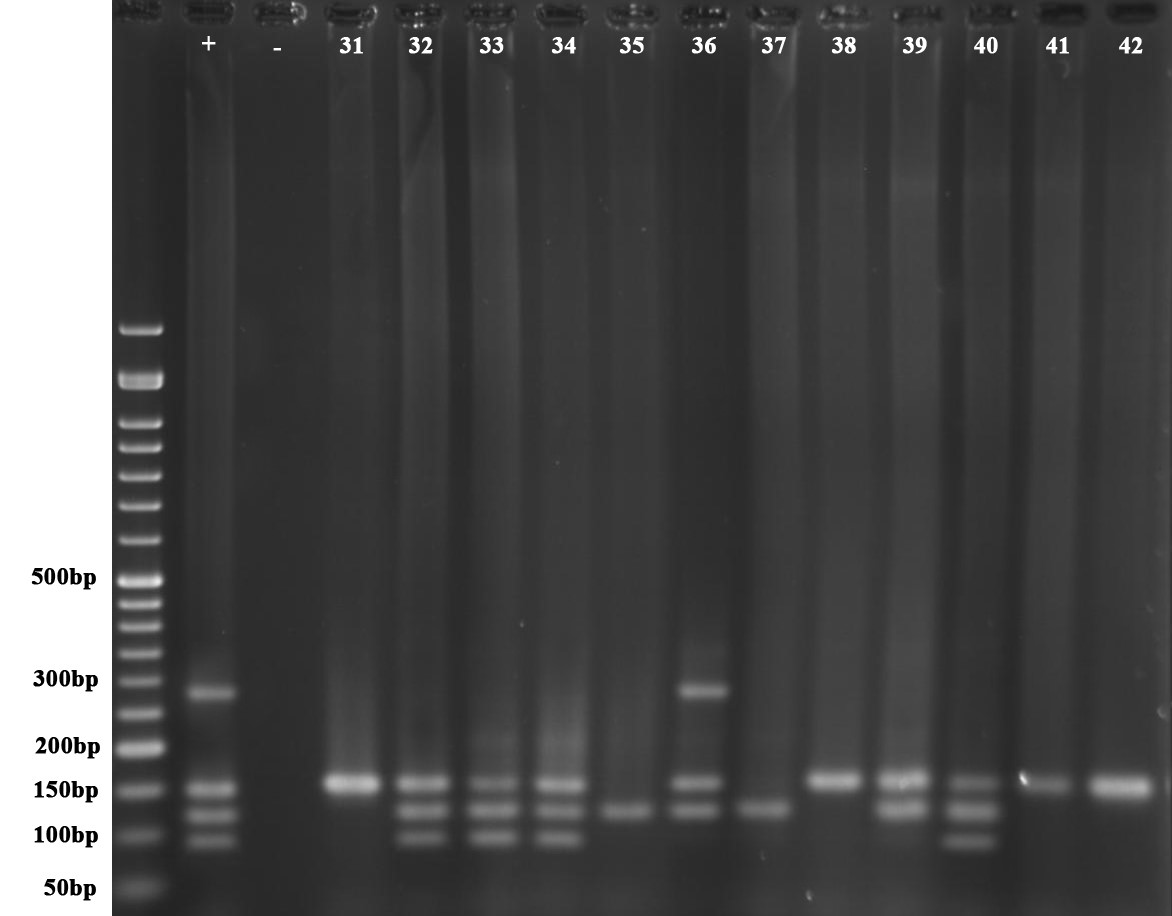
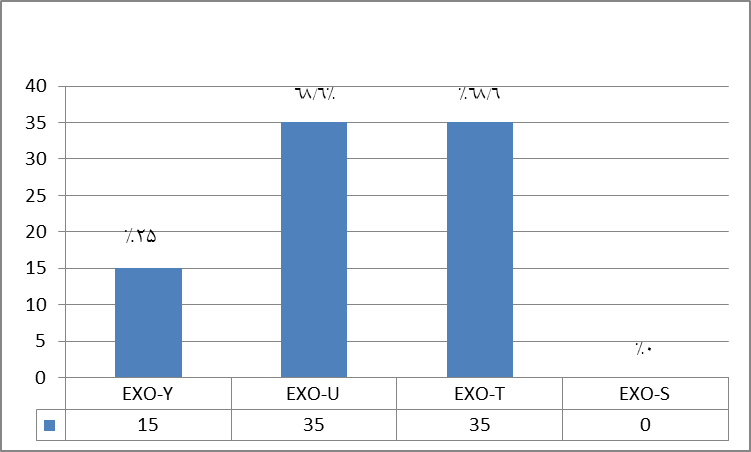
نتایج Multiplex-PCR جدایههای انسانی از نظر وجود ژنهای OPR-L، OPR-I، ALG-D، EXO-S و EXT-A
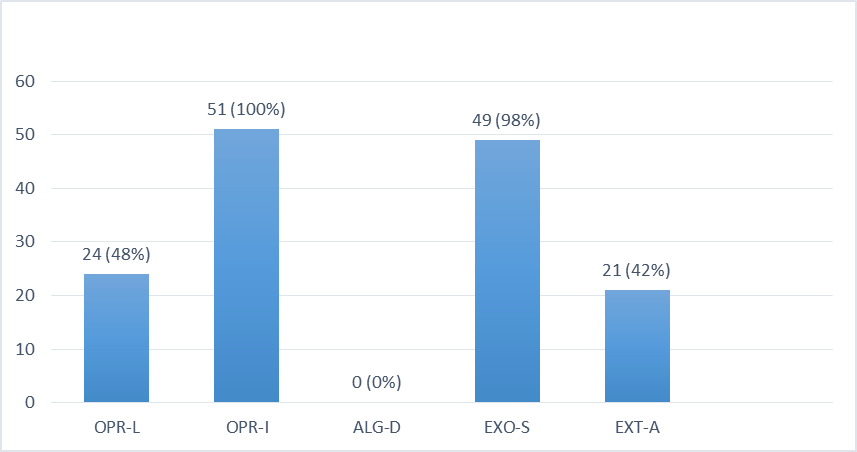
بر اساس نتایج به دست آمده، شیوع ژن OPR-I بیشتر از سایر ژنها بوده و در 100 درصد جدایههای انسانی سودوموناس آئروژینوزای بررسی شده وجود داشت. با این حال تمام نمونهها از نظر وجود ژن ALG-D منفی بودند (شکل 3). فراوانی سایر ژنها بر اساس نتایج بدست آمده در نمودار 3 نشان داده شده است.
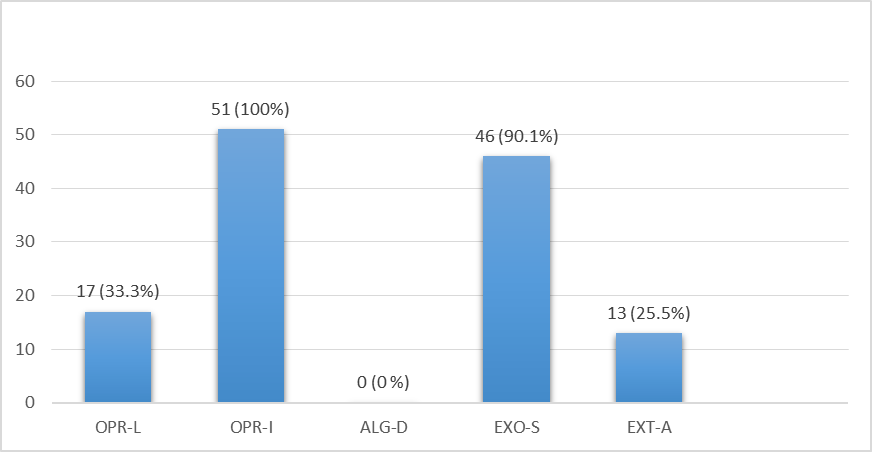
نتایج Multiplex-PCR جدایههای دامی از نظر وجود ژنهای OPR-L، OPR-I، ALG-D، EXO-S و EXT–A
بر اساس نتایج به دست آمده از بررسیهای انجام شده، شیوع ژن OPR-I بیشتر از سایر ژنها بوده و در 100 درصد جدایههای دامی سودوموناس آئروژینوزای بررسی شده وجود داشت (شکل 4). با این حال تمام نمونهها از نظر وجود ژن ALG-D منفی بودند. فراوانی سایر ژنها بر اساس نتایج بدست آمده در نمودار 4 نشان داده شده است.
نتایج آزمون حساسیت آنتی بیوتیکی ایزولههای انسانی
الگوی حساسیت و مقاومت 51 جدایه انسانی سودوموناس آئزوژینوزا نسبت به 10 آنتی بیوتیک مختلف با روش دیسک دیفیوژن پس از گذشت مدت زمان انکوباسیون لازم، قرائت و ثبت گردید. (شکل 5) بیشترین میزان مقاومت نسبت به آنتیبیوتیکهای آمپی سیلین و سفپیم (100 % مقاوم)، و کمترین میزان آن نسبت به داروی آمیکاسین (9/9 %) مشاهده شد. بیشترین میزان حساسیت نیز به آنتیبیوتیک آمیکاسین با 3/80% قرائت شد(جدول 3).
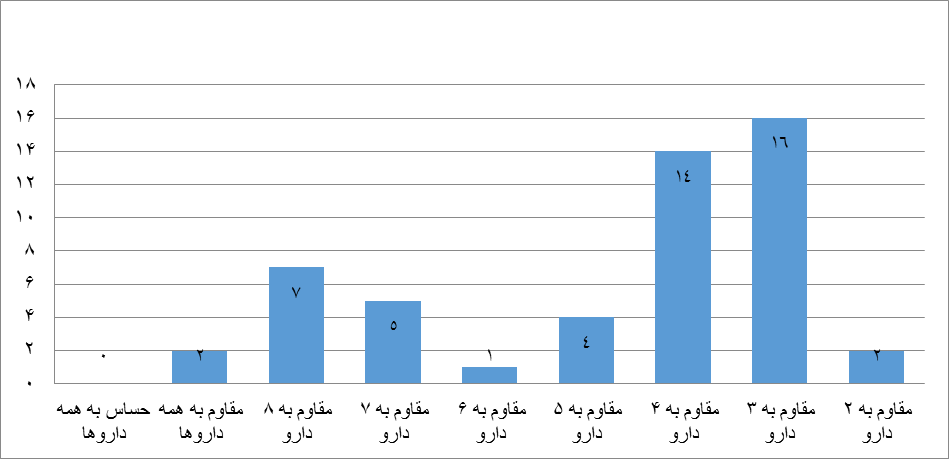
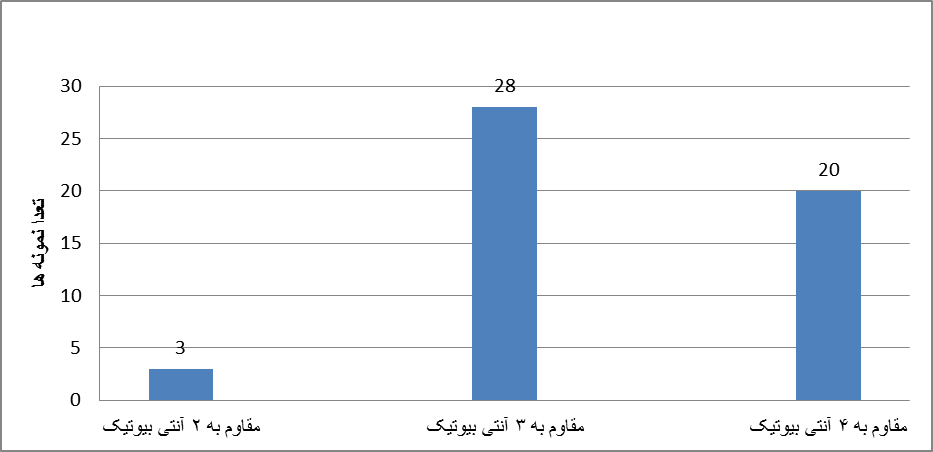
بر اساس نتایج تست آنتی بیوگرام، مقاومت همزمان به بیش از یک دارو نیز مشاهده شد. مقاومت همزمان به 3 آنتی بیوتیک (کانامیسین، آمپی سیلین، سفپیم) شایعترین حالت بوده که در 16 جدایه مشاهد گردید. همچنین 2 جدایه نسبت به تمام آنتی بیوتیکهای بررسی شده مقاومت نشان دادند. این در حالی است که حساسیت نسبت به تمام آنتی بیوتیکهای بررسی شده در هیچ یک از جدایهها وجود نداشت (نمودار 5).
جدول 3: میزان حساسیت جدایههای انسانی سودوموناس آئزوژینوزا نسبت به آنتی بیوتیکهای مختلف با روش دیسک دیفیوژن برحسب تعداد و درصد
| نوع آنتی بیوتیک | میزان مقاومت (%)
Resistance |
حساسیت متوسط(%)
Intermediate |
میزان حساسیت (%)
Sensitive |
| مروپنم | 15 (5/29) | 1 (9/1) | 35 (6/68) |
| ایمیپنم | 7 (9/13) | 8 (6/15) | 36 (5/70) |
| سفتریاکسون | 31 (61) | 4 (8/7) | 16 (2/31) |
| سیپروفلوکساسین | 11 (7/21) | 3 (8/5) | 37 (5/72) |
| سفتازیدیم | 14 (6/27) | 2 (8/3) | 35 (6/68) |
| آمپیسیلین | 51 (100) | – | – |
| سفپیم | 51 (100) | – | – |
| کانامایسین | 48 (3/94) | 1 (9/1) | 2 (8/3) |
| جنتامایسین | 13 (5/25) | – | 38 (5/74) |
| آمیکاسین | 5 (9/9) | 5 (8/9) | 41 (3/80) |
نتایج آزمون حساسیت آنتی بیوتیکی ایزولههای دامی
بررسی 51 جدایه دامی سودوموناس آئزوژینوزا نسبت به 10 آنتی بیوتیک مختلف نشان داد که بیشترین میزان میزان مقاومت نسبت به داروهای آمپی سیلین (100%) وجود دارد. حساسیت کامل (100%) نسبت به آنتی بیوتیکهای ایمی پنم، سیپروفلوکساسین، انروفلوکساسین، جنتامایسین و آمیکاسین مشاهده شد (جدول 4).
مقاومت همزمان در جدایههای دامی نیز مشاهده شد. شایعترین حالت، مقاومت همزمان نسبت به 3 آنتی بیوتیک (کانامایسین، آمپی سیلین، تتراسایکلین) بود که 25 جدایه دامی این حالت را داشتند. مقاومت نسبت به تمام آنتی بیوتیکهای بررسی شده در هیچ یک از جدایههای دامی مشاهده نگردید. (نمودار 6).
جدول 4: میزان حساسیت سویههای دامی سودوموناس آئزوژینوزا نسبت به آنتی بیوتیکهای مختلف با روش دیسک دیفیوژن برحسب تعداد و درصد
| نوع آنتی بیوتیک | میزان مقاومت (%)
Resistance |
حساسیت متوسط(%)
Intermediate |
میزان حساسیت (%)
Sensitive |
| ایمیپنم | – | – | 51 (100) |
| سفتریاکسون | 23 (1/45) | 3 (8/5) | 25 (1/49) |
| سیپروفلوکساسین | – | – | 51 (100) |
| تتراسایکلین | 48 (11/94) | 2 (92/3) | 1 (97/1) |
| آمپیسیلین | 51 (100) | – | – |
| انروفلوکساسین | – | – | 51 (100) |
| کانامایسین | 48 (11/94) | – | 3 (89/5) |
| جنتامایسین | – | – | 51 (100) |
| آمیکاسین | – | – | 51 (100) |
چندگانه
در تحقیق حاضر مشخص گردید که میزان آلودگی شیر گاوهای مبتلا به ورم پستانهای با ویژگیهای تحت بالینی 34 درصد بوده که این میزان فراوانی با توجه به نتایج مطالعات فوق همخوانی نداشته که میتواند ناشی از منطقه جغرافیایی مورد مطالعه، ضعف مدیریت مزارع، وجود آبهای آلوده و یا مخازن آلوده به این باکتری باشد. به طور کلی گزارش میزان آلودگی و بررسی مقاومتهای آنتیبیوتیکی و عوامل بیماریزای باکتری سودوموناس آئروژینوزا در دامهای ایران بسیار کم بوده ولی با توجه به افزایش شیوع و استفاده از آنتی بیوتیکهای مختلف در درمان بدون انجام آزمایش آنتی بیوگرام میتواند نقش مهمی در ایجاد سویههای مقاوم ایفا نماید. این باکتري از مهمترین عوامل بیماري و مرگ و میر در مبتلایان به فیبروز سیستیک، نئوپلاسمی و سوختگیهاي شدید در انسان است. در دهههاي اخیر در پی ابداع درمان آنتی بیوتیکی، سودوموناس آئروژینوزا به دلیل مقاومت ذاتی به اکثر آنتی بیوتیکها به عنوان یکی از مهمترین پاتوژنهاي بیمارستانی شناسایی شده است. در مطالعه آذرگون و همکاران از 51 نمونه سودوموناس آئروژینوزا جداسازی شده از بیماران مبتلا به سیستیک فیبروزیس، 2/37% مقاوم به جنتامایسین، 5/21% مقاوم به آمیکاسین، 7/15% مقاوم به سپیروفلوکساسین و 8/9% مقاوم به سفتازیدیم بودند19. در مطالعه حاضر میزان حساسیت نسبت به آمیکاسین در بین نمونههای بالینی 3/80% بود که در مقایسه با سایر مطالعات به عمل آمده مقاومت کمتری را نشان داد. از طرفی در مطالعات میرصالحیان و همکاران (20) میزان مقاومت به این آنتی بیوتیک بسیار بالا بوده است. به نظر میرسد این تفاوت میتواند به دلیل تفاوت در منبع سویهها باشد. میزان مقاومت سودوموناس آئروژینوزا به آنتی بیوتیک سیپروفلوکساسین در مطالعات یزدی و همکاران21، شاهچراغی و همکاران22، دوستی و همکاران23 و فاضلی و همکاران24 به ترتیب 42%، 41% ، 6/40% و 7/98% بود. مقایسه نتایج تحقیق حاضر (7/21% مقاومت) با تحقیقهای دیگر نشان داد که مقاومت آنتی بیوتیکی در جدایههای سودوموناس آئروژینوزا نسبت به سایر آنتی بیوتیکها کمتر بوده و هنوز کارآیی لازم را جهت درمان بیماران مبتلا به این باکتری دارا میباشد. سفتازیدیم آنتی بیوتیک دیگری است که در مطالعه حاضر مورد بررسی قرار گرفت و میزان مقاومت 6/27% از خود نشان داد. مقایسه این نتیجه با نتایج سایر مطالعات از جمله فاضلی و همکاران (100%)24، شاهچراغی و همکاران (42%)22، دوستی و همکاران (9/78%)23، خسروی و همکاران (81%)25، موحدی و همکاران (75%)26، اولیا و همکاران (44/73%)27، نشان میدهند نمونههای سودوموناس آئروژینوزا در این تحقیق کمترین میزان مقاومت به سفتازیدیم را نسبت به سایر مطالعات دارند. علت عدم مغایرت مطالعه این محققین با مطالعه پیش رو میتواند در نوع نمونه، محل انجام آزمون، بازه زمانی و دیسکهای مورد استفاده باشد. نتایج مقاومت آنتی بیوتیکی در برابر ایمی پنم (3/63%) در مطالعه میرصالحیان20 و عزیز ژاپنی28 همخوانی ندارد درحالیکه با دیگر مطالعات مانند خسروی و همکاران25، اولیا و همکاران27 و سلامی و همکاران29 همخوانی دارد. علت این عدم همخوانی میتواند در نتیجه تفاوت در نمونهها و حجم نمونهگیری باشد. در این تحقیق 9/13% و 5/29% از سویهها به ترتیب به ایمیپنم و مروپنم مقاوم بودند. بررسیها نشان میدهد، میزان مقاومت نسبت به ایمیپنم نیز درچند سال اخیر به دلیل انتشار و انتقال ژنهای کدکننده متالوبتالاکتاماز درحال افزایش است. در سال 2004 لوزارو و همکاران نشان دادند که 15% سویههای سودوموناس آئروژینوزا مقاوم به ایمیپنم بودند31. این تحقیق نتایج مشابهی را با لوزارو نشان داد، اما نسبت به سایر مطالعات مقاومت کمتری را نشان داد، دلیل این امر میتواند نوع نمونههای سودوموناس آئروژینوزا باشد که از بیماران غیر بستری مرکز درمانی جدا شدهند و به همین دلیل مقاومت کمتری را نسبت به ایمی پنم نشان دادند. فرانکو وهمکاران در سال 2010 درتحقیقی که در بیمارستانای برزیل انجام گرفت مشاهده کردند که 100% بیماران مقاوم به ایمینم بودند32. در این تحقیق میزان مقاومت به آمیکاسین 9/9% گزارش شد. ماکادو درسال 2000 نشان داد که 15% سویهها مقاوم به آمیکاسین بودند30. شاهچراغی و همکاران در سال 2003 نشان دادند که 4/93% از سویهها مقاوم به آمیکاسین بودند22. زهرا موحدی و همکاران در تحقیقی که درسال89 بر روی کودکان بخش NICU مرکز طبی کودکان انجام دادند با مقاومت 18% در مواجه با آنتی بیوتیک آمیکاسین مواجه شدند26. پروتئین OprL یکی از لیپوپروتئینهای تشکیل دهنده پمپ ایفلاکس میباشد. حضور این ژن علاوه بر اینکه یک عامل حدت در سودوموناس آئروژینوزا میباشد، نشانگر مناسبی در جهت تشخیص این گونه باکتریایی به شمار میرود. اولین بار Devos و همکاران در سال 1997، آزمون PCR ژن oprL را بر روی 20 گونه متفاوت سودوموناس جدا شده از نمونههای بالینی انجام دادند. در این مطالعه فقط گونههای سودوموناس آئروژینوزا در PCR این ژن مثبت بودند و بقیه گونههای سودوموناس منفی گزارش شدند. حساسیت و ویژگی این روش در مقایسه با روش کشت، به ترتیب 100% و 74% گزارش شد33. اصلانی و همکاران درسال 1388، شناسایی ژنهای اختصاصی جنس و گونه oprI و oprL را بر روی نمونههای سودوموناس آئروژینوزا جداسازی شده از عفونتهای تنفسی را انجام دادند. 100%نمونهها با روش PCR نسبت به ژنهای اختصاصی oprI مثبت بودند و تشخیص این گونه با استفاده از این پرایمر دارای حساسیت بالایی گزارش شد34. در مطالعه حاضر از میان نمونههای انسانی 51 ایزوله (100%) ژن oprI و 17 ایزوله (3/33%) ژن oprL و از میان نمونههای دامی 24 ایزوله (48%) دارای ژن oprL و 51 ایزوله (100%) دارای ژن oprI بودند. نجفی و همکاران در سال1392 به بررسی فراوانی ژنهای oprL و algD با طراحی پرایمرهای اختصاصی برای این ژنها پرداختند. از 70 نمونه بالینی مورد بررسی، نتايج مثبت PCR به ترتيب براي ژنهاي exoA وoprL در 68 و 70 نمونه به دست آمد كه حساسيت به ترتيب 2/97% و 100% به دست آمد35. در نتایج این مطالعه مشخص شد که فراوانی این دو ژن در بین نمونههای انسانی و دامی مشابه است. همچنین نتایج این تحقیق با سایر مطالعات همخوانی دارد. در تانزانیا شم و همکاران در سال 2001 به بررسی ورم پستانهای تحت بالینی در بین نژادهای مختلف پرداخته و به این نتیجه رسیدند که میزان ابتلا به باکتری سودوموناس آئروژینوزا از درصد کمتری نسبت به استافیلوکوک اورئوس و استرپتوکوک آگالاکتیه برخوردار است و 20 درصد ورم پستانها را ناشی از این باکتری گزارش نمودند36. جیانگ و همکاران در بررسی خود سال (2015) بر روی 22759 نمونه شیر گاوهای مبتلا به ورم پستانهای تحت بالینی، میزان آلودگی به سودوموناس آئروژینوزا را 55/62 درصد گزارش نمودند (37). در پژوهشی بر روی باکتریهای ایجادکننده ورم پستان دوره خشکی در تبریز به این نتیجه رسیدند که 32/13 درصد نمونهها آلوده به سودوموناس آئروژینوزا میباشند. کیرک و همکاران برنامه مدونی برای کنترل ورم پستانهای ناشی از سودوموناس آئروژینوزا در گلههای شیری ارائه میکنند. او در این برنامه به عوامل ایجاد کننده و راههای کنترل و مهار این عوامل در جهت کاهش ورم پستان ناشی از سودوموناس آئروژینوزا میپردازد. وی در این برنامه به انجام مرتب و دوره ای کشت نمونههای شیر دامهای دارای علائم، کنترل و آزمایشات میکروبی آب دامداری، اجرای برنامه صحیح بهداشتی اشاره مینماید38. زادوکس و همکاران در سال (2011)، استفاده از محلول کلرهگزیدین را در ضدعفونی سرپستانها در کاهش میزان ابتلا موثر میدانند39. سودوموناس آئروژینوزا از جمله باكتريهاي مقاوم است كه به دليل كاهش نفوذپذيري دارو و توليد آنزيمهاي مختلف، داراي مقاومت بالايي نسبت به آنتي بيوتيكها میباشد. تیله و همکاران در سال (2003)، بررسی بر روی میزان حساسیت آنتی بیوتیکی عوامل ایجاد کننده ورم پستان در گله گاوهای شیری را انجام داده و میزان مقاومت باکتری سودوموناس آئروژینوزا جداشده از ورم پستان گاوهای مبتلا را که دارای سنین مختلف بودند گزارش نمودند. در نتایج تیله میزان مقاومت باکتری سودوموناس آئروژینوزا به آنتی بیوتیکهای آمپی سیلین، آموکسی سیلین، تتراسایکلین، انروفلوکساسین، تریمتوپریم/سولفانامید، سفوپرازون و استرپتومایسین بین سالهای 2003-1999 به ترتیب برابر با 94 درصد، 93 درصد، 100 درصد، 100 درصد، 96 درصد اعلام شد40. درتحقیق سال 92 دوستی و همکاران 1/55% از بیماران مقاوم به ایمیپنم بودند23. خوشبختانه در مطالعه ما مشخص گردید که هیچ یک از نمونههای دامی نسبت به ایمیپنم مقاومت نداشته ولی میزان مقاومت در برابر آنتیبیوتیکهای تتراسایکلین و آمپیسیلین با توجه به مصرف زیاد این نوع آنتیبیوتیکها رو به افزایش بوده که میبایست روند انتخاب شیوه درمان در بین مزارع پرورش گاو تغییر یابد. اگزوتوکسین A سم اصلی تولید شده توسط باکتری سودوموناس آئروژینوزا بوده و از عوامل مرگ و میر میباشد. این سم به صورت کروموزمومی کد شده و از ژن آن فقط یک نسخه وجود دارد که در 90% سویهها شناسایی شده است. این سم با غیر فعال ساختن فاکتور 2 طویل سازی پروتئین موجب توقف سنتز و در نهایت مرگ سلول میشود. اگزوتوکسین A دارای 3 ناحیه میباشد: ناحیه 1 به رسپتورهای سلول میزبان متصل شده و اندوسیتوز را آغاز میکند، با اسیدی شدن اندوزوم، ناحیه 2 حرکت توکسین به سمت سیتوپلاسم را موجب شده و ناحیه 3 انتقال ADP ریبوز به EF2 را کاتالیز میکند10.
نتیجهگیری
با توجه به اهمیت شناسایی سریع باکتری سودوموناس آئروژینوزا و با توجه به مشکلات موجود در روشهای بیوشیمیایی، روشهای مولکولی مانند PCR روشی حساس و سریع در شناسایی این باکتری میباشد. به علاوه شناسایی همزمان چند فاکتور ویرولانس و با روش Multiplex PCR اختصاصیت بالایی به این کار میبخشد. ژنهای oprL و ETA دارای شیوع بالایی در جدایههای سودوموناس آئروژینوزا میباشند و نشانگر مناسبی جهت تشخیص این باکتری میباشند. اگزوتوکسین A بعلاوه اینکه از عوامل اصلی پاتوژنز باکتری سودوموناس آئروژینوزا است، شیوع بالایی نیز در بین ایزولهها دارد. بنابراین لزوم توجه به سویههای جدا شده از بالین و دام که حاوی این ژن هستند وجود دارد تا از اثرات این توکسین بر بافتهای دامی و انسانی جلوگیری شود. مقاومتهای آنتی بیوتیکی در سویههای دامی و انسانی شیوع بالایی دارند و لزوم توجه به مصرف مناسب و به اندازه آنتی بیوتیکها احساس میشود.
سپاسگزاری
این مقاله مستخرج از پایان نامه با کد 678 در دانشکده دامپزشکی تهران بوده و از کلیه عزیزانی که در انجام این فعالیت علمی راهنمایی مفید و ارزنده داشتند قدردانی و تشکر میگردد.
References
- Stover C, Pham X, Erwin A, Mizoguchi S, Warrener P, Hickey M, et al. Complete genome sequence of Pseudomonas aeruginosa PAO1, an opportunistic pathogen. Nature. 2000;406(6799):959-64.
- Choi K-H, Kumar A, Schweizer HP. A 10-min method for preparation of highly electrocompetent Pseudomonas aeruginosa cells: application for DNA fragment transfer between chromosomes and plasmid transformation. Journal of microbiological methods. 2006;64(3):391-7.
- Smith EE, Buckley DG, Wu Z, Saenphimmachak C, Hoffman LR, D’Argenio DA, et al. Genetic adaptation by Pseudomonas aeruginosa to the airways of cystic fibrosis patients. Proceedings of the National Academy of Sciences. 2006;103(22):8487-92.
- Perron K, Caille O, Rossier C, van Delden C, Dumas J-L, Köhler T. CzcR-CzcS, a two-component system involved in heavy metal and carbapenem resistance in Pseudomonas aeruginosa. Journal of Biological Chemistry. 2004;279(10):8761-8.
- Smith RS, Iglewski BH. Pseudomonas aeruginosa quorum sensing as a potential antimicrobial target. Journal of Clinical Investigation. 2003;112(10):1460.
- Jae LT, Raaben M, Riemersma M, van Beusekom E, Blomen VA, Velds A, et al. Deciphering the glycosylome of dystroglycanopathies using haploid screens for lassa virus entry. Science. 2013;340(6131):479-83.
- Carmeli Y, Troillet N, Karchmer AW, Samore MH. Health and economic outcomes of antibiotic resistance in Pseudomonas aeruginosa. Archives of Internal Medicine. 1999;159(10):1127-32.
- Arun IS. Studies on Immunogenicity and Protective Efficacy of Different Recombinant Proteins of Pseudomonas aeruginosa 2015.
- Köhler T, Buckling A, Van Delden C. Cooperation and virulence of clinical Pseudomonas aeruginosa populations. Proceedings of the National Academy of Sciences. 2009;106(15):6339-44.
- Aghaei SS, Javadi A, Sharifi Y, Morovvati A. Detection of Exotoxin A, Y, T, U, S genes of Pseudomonas aeruginosa Isolates Resistant to Third-Generation Cephalosporins in Clinical Samples of Hospitalized Patients in Hospitals of Qom City, Iran. Qom University of Medical Sciences Journal. 2016;10(1):48-55.
- Sana TG, Baumann C, Merdes A, Soscia C, Rattei T, Hachani A, et al. Internalization of Pseudomonas aeruginosa strain PAO1 into epithelial cells is promoted by interaction of a T6SS effector with the microtubule network. MBio. 2015;6(3):e00712-15.
- Bannerman DD, Chockalingam A, Paape MJ, Hope JC. The bovine innate immune response during experimentally-induced Pseudomonas aeruginosa mastitis. Veterinary immunology and immunopathology. 2005;107(3):201-15.
- Rella M, Haas D. Resistance of Pseudomonas aeruginosa PAO to nalidixic acid and low levels of beta-lactam antibiotics: mapping of chromosomal genes. Antimicrobial Agents and Chemotherapy. 1982;22(2):242-9.
- Miller WL, Matewish MJ, McNally DJ, Ishiyama N, Anderson EM, Brewer D, et al. Flagellin glycosylation in Pseudomonas aeruginosa PAK requires the O-antigen biosynthesis enzyme WbpO. Journal of Biological Chemistry. 2008;283(6):3507-18.
- Khan AA, Cerniglia CE. Detection of Pseudomonas aeruginosa from clinical and environmental samples by amplification of the exotoxin A gene using PCR. Applied and environmental microbiology. 1994;60(10):3739-45.
- Salman M, Ali A, Haque A. A novel multiplex PCR for detection of Pseudomonas aeruginosa: A major cause of wound infections. Pakistan journal of medical sciences. 2013;29(4):957.
- Gawish AA, Mohamed NA, El-Shennawy GA, Mohamed HA. An investigation of type 3 secretion toxins encoding-genes of Pseudomonas aeruginosa isolates in a University Hospital in Egypt. Journal of Microbiology and Infectious Diseases. 2013;3(03).
- Azargoon R, Doustdar F, Khanbabaei G, Ghazi M, Mehrnejad F, Goudarzi H. Type III secretion system characterization of Pseudomonas aeruginosa isolates associated with cystic fibrosis. Research in Medicine. 2013;37(3):1890-193.
- Mirsalehian A, Bahador A, Bigverdi R, Goli H. Prevalence of MBL-producing Pseudomonas aeruginosa isolated from burn patients. Tehran University of Medical Sciences. 2011;68(10).
- Yazdi HR, Nejad GB, Peerayeh SN, Mostafaei M. Prevalence and detection of metallo-β-lactamase (MBL)-producingPseudomonas aeruginosa strains from clinical isolates in Iran. Annals of microbiology. 2007;57(2):293.
- Shahcheraghi F, Nikbin VS, Feizabadi MM. Identification and genetic characterization of metallo-beta-lactamase-producing strains of Pseudomonas aeruginosa in Tehran, Iran. New Microbiologica. 2010;33(3):243-8.
- Doosti M, Ramazani A, Garshasbi M. Identification and characterization of metallo-β-lactamases producing Pseudomonas aeruginosa clinical isolates in University Hospital from Zanjan Province, Iran. Iranian biomedical journal. 2013;17(3):129.
- Fazeli H, Moslehi Z, Irajian G, Salehi M. Determination of Drug resistance patterns and detection of bla-VIM gene in Pseudomonas aeruginosastrains Isolated from burned patients in the Emam Mosa Kazem hospital, Esfahan, Iran (2008-9). Iranian Journal of Medical Microbiology. 2010;3(4)1-8.
- Khosravi AD, Mihani F. Detection of metallo-β-lactamase–producing Pseudomonas aeruginosa strains isolated from burn patients in Ahwaz, Iran. Diagnostic microbiology and infectious disease. 2008;60(1):125-8.
- Movahedi Z, Pourakbari B, Mahmoudi S, Sabouni F, ASHTIAnI MH, Sadeghi RH, et al. Pseudomonas aeruginosa infection among cystic fibrosis and ICU patients in the referral children medical hospital in Tehran, Iran. Journal of preventive medicine and hygiene. 2013;54(1):24.
- Owlia P, Saderi H, Karimi Z, Rad A, Bagher SM, Bahar MA. Phenotypic detection of Metallo-beta-Lactamase producing Pseudomonas aeruginosa strains isolated from burned patients. Iranian Journal of Pathology. 2008;3(1):20-5.
- Japoni A, Alborzi A, Kalani M, Nasiri J, Hayati M, Farshad S. Susceptibility patterns and cross-resistance of antibiotics against Pseudomonas aeruginosa isolated from burn patients in the South of Iran. Burns. 2006;32(3):343-7.
- Salami H. owlia P, Yakhchali B, Rastegar lari A. Drug susceptibility and molecular epidemiology of pseudomonas aeruginosa isolated in a burn unit. J infect Dis. 2009;5(4):308-13.
- Makedou K, Tsiakiri E, Bisiklis A, Chatzidimitriou M, Halvantzis A, Ntoutsou K, et al. Changes in antibiotic resistance of the most common Gram-negative bacteria isolated in intensive care units. Journal of Hospital Infection. 2005;60(3):245-8.
- Luzzaro F, Endimiani A, Docquier J-D, Mugnaioli C, Bonsignori M, Amicosante G, et al. Prevalence and characterization of metallo-β-lactamases in clinical isolates of pseudomonas aeruginosa. Diagnostic microbiology and infectious disease. 2004;48(2):131-5.
- Franco MRG, Caiaffa-Filho HH, Burattini MN, Rossi F. Metallo-beta-lactamases among imipenem-resistant Pseudomonas aeruginosa in a Brazilian university hospital. Clinics. 2010;65(9):825-9.
- Devos D, Garmendia J, Lorenzo Vd, Valencia A. Deciphering the action of aromatic effectors on the prokaryotic enhancer‐binding protein XylR: a structural model of its N‐terminal domain. Environmental microbiology. 2002;4(1):29-41.
- Aslani M, Hashemipour M, NikBin V, Shahcheraghi F, Eydi A, Sharafi Z. PCR identification of Pseudomonas aeruginosa based on two outermembrane lipoprotein oprI, oprL, and exotoxin A gene. J Med Sci Lorestan. 2009;11(2):21-6.
- Rafatbakhsh-Iran S, Salehzadeh A, Yousefimashouf R, Najafimosleh M, Karimitabar Z, Khedri M. Bacteria of Phlebotominae Sand Flies Collected in Western Iran. Iranian Journal of Health, Safety and Environment. 2015;2(3):313-9.
- Shem M, Malole J, Machangu R, Kurwijila L, Fujihara T. Incidence and causes of sub-clinical mastitis in dairy cows on smallholder and large scale farms in tropical areas of Tanzania. Asian Australasian Journal of Animal Sciences. 2001;14(3):372-7.
- Zhong H, Jiang Y, Zeng G, Liu Z, Liu L, Liu Y, et al. Effect of low-concentration rhamnolipid on adsorption of Pseudomonas aeruginosa ATCC 9027 on hydrophilic and hydrophobic surfaces. Journal of hazardous materials. 2015;285:383-8.
- Kirk J, Mellenberger R. Pseudomonas-infected dairy cows. Extension bulletin E-Cooperative Extension Service. 1987.
- Zadoks RN, Middleton JR, McDougall S, Katholm J, Schukken YH. Molecular epidemiology of mastitis pathogens of dairy cattle and comparative relevance to humans. Journal of mammary gland biology and neoplasia. 2011;16(4):357-72.
- Teale C, Martin P, Watkins G. VLA antimicrobial sensitivity report. UK: Crown. 2002.
- Doosti A, Pourabbas M, Arshi A, Chehelgerdi M, Kabiri H. TEM and SHV genes in Klebsiella pneumoniae isolated from cockroaches and their antimicrobial resistance pattern. Osong public health and research perspectives. 2015;6(1):3-8.
سودوموناس آئروژینوزا ، Multiplex-PCR ، مقاومت آنتیبیوتیکی، آلژینات، اگزوتوکسین